
Dr. Giuseppe Musolino
musolino.press@email.it
www.musolino.jimdo.com
L’antiossidante dimagrante.
Generazione X
Esiste una nuova generazione di molecole ancora poco conosciuta ma dalle potenzialità enormi. Tra queste, una delle più interessanti è l’astaxantina, che dalle ultime ricerche effettuate ha fatto emergere risultati sorprendenti. Da tempo erano noti i suoi effetti sulla salute, giacché si tratta di uno degli antiossidanti più potenti attualmente conosciuti. Ma ciò che ha letteralmente sbalordito è l’effetto positivo che la molecola ha di recente evidenziato tanto sulla performance sportiva quanto sulla composizione corporea (dimagrimento). Risultati fino a poco tempo fa insospettati. In tal modo, questo relativamente nuovo composto si sta imponendo ai vertici dell’attenzione come uno dei più efficaci supporti nutrizionali, in particolare per l’atleta.
Rosa shocking
L’astaxantina è un derivato dei carotenoidi, più specificatamente appartiene alla classe delle xantofille. È un pigmento rosso, responsabile del caratteristico colore rosa delle piume dei fenicotteri, della carne del salmone, delle trote salmonate e dei carapaci dei gamberetti (1, 2).
La principale fonte di provenienza è vegetale, in quanto viene esclusivamente sintetizzata da un’alga (Haematococcus pluvialis) come sostanza fotoprotettiva per le cellule di questa (3). Gli animali succitati, non essendo in grado di produrre astaxantina, la introducono attraverso la dieta, ovvero il fitoplancton, che a sua volta lo accumula a partire dall’alga (4). I livelli di astaxantina nei pesci variano molto a seconda della provenienza: una specie proveniente dal Pacifico può contenere concentrazioni molto maggiori rispetto ad una stessa varietà originaria dell’Atlantico (5).
Anche i pesci si tingono
La molecola viene comunque utilizzata anche in forma sintetica, come colorante. In questo modo viene aggiunta ai mangimi allo scopo di impartire il colore rosato al muscolo di pesci allevati, che altrimenti risulterebbero poco appetibili per i consumatori (6). Ad esempio, le carni della trota nota come “salmonata” per il colore rosa delle sue carni, in realtà sarebbero bianco-rosate, ma la colorazione rosa è una peculiarità che ne determina il successo sul mercato: ecco dunque che tramite utilizzo di astaxantina, si ottiene il colore desiderato (fig. 1) (7).
Lo stesso discorso vale per il salmone. Siamo solitamente portati a ritenere che più è rosso più è buono, ma come visto non è cosi: il colore dipende solo dall’alimentazione dell’animale. Poiché però ciò genera la domanda di mercato, alcune case produttrici di carotenoidi hanno addirittura provveduto a fornire agli allevatori di salmone una guida per orientarsi verso le dosi da utilizzare in relazione alle sfumature di colore rosa desiderato.
Pesci d’aprile.
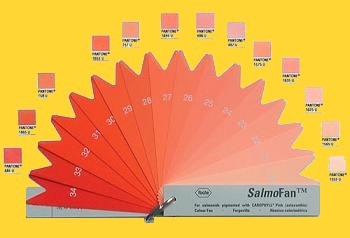
Fig. 1 L'astaxantina viene utilizzata in commercio per dare ai pesci la colorazione voluta. Alcune multinazionali forniscono addirittura agli allevatori una guida per scegliere la tonalità di rosa desiderata.
Rosa VS Ros
Ma non si tratta solo di una caratteristica meramente estetica. Già da molto tempo, si sa che gli antiossidanti si sfruttano anche e soprattutto per il loro ruolo protettivo contro il danno ossidativo a carico dei lipidi che si può instaurare durante lo stoccaggio dei pesci (8, 9 , 10, 11), così da prevenirne l’irrancidimento e mantenerne il valore nutrizionale (12).
L’astaxantina, da quel valido antiossidante che è, ha dimostrato di poter inibire la perossidazione degli acidi grassi (13, 14, 15), salvaguardando così nutrienti importanti come gli acidi grassi omega-3 (16), noti protettori a livello cardiocircolatorio. Gli acidi grassi polinsaturi (non solo dei pesci, ma chiaramente anche nostri), quali appunto gli omega-3, sono infatti un comune obiettivo dell’azione ossidante dei radicali liberi e dei Ros (specie reattive dell’ossigeno), prodotti dal nostro metabolismo aerobico (17, 18, 19, 20). È quel meccanismo per cui, sebbene indispensabile alla vita, l’ossigeno può diventare dannoso in certe condizioni (paradosso dell’ossigeno) (21).
Ros never sleeps
L’ossidazione è un processo al quale noi siamo costantemente esposti: inquinamento, fumo di tabacco, esposizione ad agenti chimici, raggi UV e altre fonti di radiazioni ionizzanti (22, 23). Il processo, che non riguarda solo i lipidi ma anche altre componenti della cellula (Dna, proteine ecc.), col tempo può portare danni importanti (24, 25). Il nostro organismo ha sviluppato dei sistemi di protezione altamente efficaci: catalasi, perossidasi, ossido nitrico, superossido dismutasi, glutatione, melatonina, acido urico, molecole ad attività antiossidante come i carotenoidi e le vitamine C ed E (18, 21, 26, 27, 28). Tuttavia, queste difese non sono in grado di contrastare totalmente il danno ossidativo che nel tempo contribuisce all’invecchiamento (29) ed all’insorgenza di diversi fenomeni patologici, quali retinopatia e degenerazione maculare (30), ischemia (31), cancerogenesi (32).
Salviamoci la pelle
L’astaxantina, invece, si è dimostrata un antiossidante molto più potente di altri maggiormente noti come il betacarotene o la vitamina E (33, 34, 35, 36, 37, 38, 39). Nei confronti di quest’ultima, si è addirittura rivelata da 100 a 500 volte più efficace nel prevenire la perossidazione degli acidi grassi (13, 14, 34, 40): in topi privati di vitamina E, il compito di far resistere i lipidi all’ossidazione viene svolto proprio dall’astaxantina (39, 41). In questo senso, la molecola ha dimostrato di poter inibire anche l’ossidazione delle LDL e dunque di contribuire alla prevenzione del processo aterosclerotico (42).
Oltre a ciò, la molecola ha dimostrato un’attività farmacologica molto estesa. In particolar modo, sono emerse spiccate azioni antitumorali (43, 44, 45, 46, 47), immunomodulatrici (48, 49), antidiabetiche (50) e antinfiammatorie (51). Ancora, sembra essere in grado di inibire l’enzima 5-alfa reduttasi, noto responsabile dell’alopecia androgentica (oltre che dell’iperplasia e del carcinoma prostatico), esercitando dunque una possibile attività contro la caduta dei capelli. Infine, l’astaxantina protegge la pelle e la retina dall’effetto dannoso dei raggi ultravioletti, e in tal modo rappresenta un valido alleato contro i danni derivanti dell’esposizione solare.
X Factor
Allo stress ossidativo sopraesposto, va poi aggiunto quello derivante dall’allenamento (specie se aerobico e ancor più se esaustivo), che ovviamente incrementa in modo notevole l’assorbimento ed il consumo di ossigeno. Questo maggior utilizzo di O2 accresce ulteriormente la generazione di Ros.
Inoltre, bisogna considerare un altro aspetto. La fatica indotta dall’esercizio è attribuibile a diversi fattori, tra cui alcuni dei più importanti sono (52, 53, 54):
-
l’esaurimento del glicogeno,
-
la formazione di prodotti come l’acido lattico,
-
il danno muscolare indotto dall’allenamento.
E qui arriviamo al punto focale: l’utilizzo dell’astaxantina nell’ambito sportivo. Punto che ha riservato più di una sorpresa, giacché la molecola (in esperimenti in vivo) ha dimostrato effetti per certi versi sbalorditivi, come ad esempio quello di poter migliorare la prestazione ed aiutare nel dimagrimento. Vediamo meglio come.
Astaxantina e attività fisica
Noi sappiamo che nel corso di un’attività fisica, il primo carburante ad essere consumato è il glucosio nel sangue. Invece, somministrando l’astaxantina pre-allenamento e misurando le concentrazioni glicemiche al termine dell’esercizio, sono stati sorprendentemente rilevati valori di glucosio e di glicogeno (tanto epatico quanto muscolare) ben maggiori del normale (55).
Di converso, sono stati registrati aumentati i livelli di acidi grassi nel sangue, che invece normalmente risultano bassi in quello stesso arco di tempo di allenamento proprio perché di solito è il glucosio ad essere utilizzato come fonte energetica. A conferma di ciò, il trattamento con astaxantina si è accompagnato a significativa diminuzione dell’accumulo di grasso corporeo (55, 56).
Quindi, primo punto: l’astaxantina aumenta l’utilizzazione di acidi grassi come fonte di energia e perciò risparmia il glicogeno, che potrebbe così fornire un importante vantaggio per le fasi successive di esercizio ritardando la comparsa dei sintomi di affaticamento (55, 57).
Secondo punto: la somministrazione di astaxantina ha evidenziato minor produzione di acido lattico, che sappiamo essere generato come risultato del metabolismo glucidico. Meno acido lattico significa meno carboidrati utilizzati durante l’esercizio, a ulteriore conferma di quanto sopra detto.
Terzo punto: l’astaxantina attenua i danni indotti dall’esercitazione nei muscoli e nel cuore, tra cui una dannosa infiltrazione di neutrofili (54). In tal modo può dunque ridurre i tempi di recupero, oltre ad apportare giovamento in patologie come tendiniti, dolori muscolari e articolari, con significativa diminuzione della sofferenza e maggiore mobilità articolare. I benefici si rendono evidenti anche a livello del tono muscolare e articolare, oltre che sulla compattezza della pelle (55).
Maglia rosa
Da tutti questi dati è possibile concludere che, oltre ai plurimi effetti antiossidanti, l’astaxantina è in grado di intervenire sulle succitate cause della fatica e dei danni post-allenamento, ritardandone la comparsa e migliorando in ultimo la prestazione e il recupero. E il tutto si accompagna ad una diminuzione di grasso corporeo. Tutto ciò rappresenta una novità assoluta, perché finora gli effetti dell’astaxantina in questa direzione non erano stati dimostrati.
La molecola è stata sottoposta a numerosi test mutageni e teratogeni per valutarne la tollerabilità e l’eventuale tossicità, dai quali non è emerso alcun effetto collaterale, ragion per cui è lecito ritenerla estremamente affidabile. Una maglia rosa tra tutte le nuove molecole attualmente in circolo.
BIBLIOGRAFIA
1. Vernon-Carter EJ, Ponce-Palafox JT, Pedroza-Islas R, Pigmentation of Pacific white shrimp (Penaeus vannamei) using Aztec marigold (Tagetes erecta) extracts as the carotenoid source, Arch Latinoam Nutr, 46 (3), 243-6, 1996.
2. Torrissen, OJ, Christiansen R, Requirements for carotenoids in fish diets, J Appl Ichthyol, 11, 225-230, 1995.
3. Kobayashi M et al, Antioxidant role of astaxanthin in the green alga Haematococcus pluvialis, Appl Microbiol Biotechnol, 48, 351-356, 1997.
4. Britton G, Liaaen-Jensen S, Pfander H, Carotenoids today and challenges for the future, In: Britton G, Liaaen-Jensen S, Pfander H [eds], Carotenoids vol, 1A: Isolation and Analysis, Basel: Birkhäuser, 1995.
5. Turujman SA, Wamer WG, Wei RR, Albert RH, Rapid liquid chromatographic method to distinguish wild salmon from aquacultured salmon fed synthetic astaxanthin, J AOAC Int, 80 (3), 622-632, 1997.
6. McCoy M, Astaxanthin market a hard one to crack, Chem & Eng News, 77, 15-17, 1999.
7. Hinostroza GC, Huberman A, de la Lanza G, Monroy-Ruiz J, Arch Latinoam Nutr, Pigmentation of the rainbow trout (Oncorhynchus mykiss) with oil-extracted astaxanthin from the langostilla (Pleuroncodes planipes), 47 (3), 237-41, 1997.
8. Witting LA, Horwitt MK, The effect of antioxidant deficiency on tissue lipid composition in the rat. I. Gastrocemius and quadriceps muscle, Lipids, 2, 89-96, 1967.
9. Witting LA, Theron JJ, Horwitt MK, The effect of antioxidant deficiency in tissue lipid composition in the rat. II. Liver, Lipids, 2, 97-102, 1967.
10. Witting LA, Horwitt MK, Effect of degree of fatty acid unsaturation in tocopherol deficiency-induced creatinuria, J Nutr, 82, 19-33, 1964.
11. Bernhard K, Leisinger S, Pederson W, Vitamin E and arachidonsuare, bildung in der leber, Helv Chim Acta, 46, 1767-1772, 1963.
12. Jensen C et al, Effect of dietary levels of fat, alpha-tocopherol and astaxanthin on colour and lipid oxidation during storage of frozen rainbow trout (Oncorhynchus mykiss) and during chill storage of smoked trout, Zeitschrift F Lebensmittel-Untersuchung U, Forschung A, 207 (3), 189-196, 1998.
13. Nishigaki I, Dmitrovskii AA, Miki W, Yagi K, Suppressive effect of astaxanthin on lipid peroxidation induced in rats. J. Clin. Biochem. Nutr, 16, 161-166, 1994.
14. Krinsky NI, Actions of carotenoids in biological systems, Annu Rev Nutr, 13, 561-587, 1993.
15. Palozza P, Krinsky NI, ß-Carotene and -tocopherol are synergistic antioxidants, Arch Biochem Biophys, 297, 184-187, 1992.
16. Baker RTM, Davies SJ, Increased production of docosahexaenoic acid (22:6n-3, DHA) in catfish nutritionally stressed by the feeding of oxidized oils and the modulatory effect of dietary -tocopheryl acetate, J Fish Biol, 49, 748-752, 1996.
17. Darley-Usmar V, Halliwell B, Blood radicals: reactive nitrogen species, reactive oxygen species, transition metal ions, and the vascular system, Pharm Res, 13 (5), 649-662, 1996.
18. Halliwell B, Oxidative stress, nutrition, and health, Experimental strategies for optimization of nutritional antioxidant intake in humans, Free Radic Res, 25 (1), 57-74, 1996.
19. Ames BN, Shigenaga MK, Hagen TM, Oxidants, antioxidants and the degenerative diseases of aging, Proc Natl Acad Sci USA, 90 (17), 7915-7922 1993.
20. Sies H, Oxidative Stress: Oxidants and Antioxidants, Academic Press New York, NY, 1991.
21. Davies KJ, Oxidative stress: the paradox of aerobic life, Biochem Soc Symp, 61, 1-31, 1995.
22. Papas AM, Determinants of antioxidant status in humans, In: Papas AM [ed], Antioxidant Status, Diet, Nutrition and Health, Boca Raton: CRC Press, 1999.
23. Møller P, Wallin H, Knudsen LE, Oxidative stress associated with exercise, psychological stress and life-style factors, Chem Biol Interact, 102 (1), 1-36, 1996.
24. Asha DS, Indian J Gerontol, 16, 79-95, 2002.
25. Tiidus PM, Houston E, Sports Med, 20, 12-23, 1995.
26. Reiter RJ, Oxidative damage in the central nervous system: protection by melatonin. Prog. Neurobiol, 56 (3), 359-384, 1998.
27. Yu ZF et al, Uric acid protects neurons against excitotoxic and metabolic insults in cell culture, and against focal ischemic brain injury in vivo, J Neurosci Res, 53 (5), 613-625, 1998.
28. Fahey RC and Sundquist AR, Evolution of glutathione metabolism, Adv Enzymol, Related Areas Mol Biol, 64, 1-53, 1991.
29. Ames, BN, Shigenaga MK, Oxidants are a major contributor to aging, Ann N Y Acad Sci, 663, 85-96, 1992.
30. Gerster H, Antioxidant protection of the ageing macula, Age Ageing, 20, 60-69, 1991.
31. Takayama F et al, Chemiluminescence-HPLC assay of phosphatidylcholine hydroperoxide generated by ischemia-reperfusion in the liver of rats, Biochem Pharmacol, 44, 2412-4, 1992.
32. Breimer LH, Molecular mechanisms of oxygen radical carcinogenesis and mutagenesis: the role of DNA base damage, Mol Carcinog, 3, 188-197, 1990.
33. Kurihara H, Koda H, Asami S, Kiso Y, Tanaka T, Contribution of the antioxidative property of astaxanthin to its protective effect on the promotion of cancer metastasis in mice treated with restraint stress, Life Sci, 70 (21), 2509-2520, 2002.
34. Kobayashi M, In vivo antioxidant role of astaxanthin under oxidative stress in the green alga Haematococcus pluvialis, Appl Microbiol Biotechnol, 54 (4), 550-555, 2000.
35. Lawlor SM, O’Brien NM, Astaxanthin: antioxidant effects in chicken embryo fibroblasts, Nutr Res, 15, 1695-1704, 1995.
36. Britton G, Structure and properties of carotenoids in relation to function, FASEB J, 9, 1551-1558, 1995.
37. Palozza P, Krinsky NI, Astaxanthin and canthaxanthin are potent antioxidants in a membrane model, Arch Biochem Biophys, 297, 291-295, 1992.
38. Lim BP, Antioxidant activity of xanthophylls on peroxyl radical-mediated phospholipid peroxidation, Biochim Biophys Acta, 1126, 178-184, 1992.
39. Miki W, Biological functions and activities of animal carotenoids, Pure Appl Chem, 63 (1), 141-146, 1991.
40. Shimidzu N, Goto M, Miki W, Carotenoids as singlet oxygen quenchers in marine organisms, Fish Sci, 62, 134-137, 1996.
41. Kurashige M et al, Inhibition of oxidative injury of biological membranes by astaxanthin, Physiol Chem Pys & Med, NMR, 22, 27-38, 1990.
42. Iwamoto T et al, Inhibition of low-density lipoprotein oxidation by astaxanthin, J Atheroscler Thromb, 7 (4), 216-22, 2000.
43. Jyonouchi H, Sun S, Iijima K, Gross MD, Antitumor activity of astaxanthin and its mode of action, Nutr Cancer, 36 (1), 59-65, 2000.
44. Chew BP et al, Dietary beta-carotene and astaxanthin but not canthaxanthin stimulate splenocyte function in mice, Anticancer Res, 19 (6B), 5223-7, 1999.
45. Nishino H, Cancer prevention by carotenoids, Mutat Res, 402,159-163, 1998.
46. Sterlie M et al, On bioavailability and deposition of bent Z-isomers of astaxanthin, Proceedings of the First International Congress on Pigments in Food Technology, Sevilla, Spain, pp157-161, 24-26 March 1999.
47. Sterlie M et al, Blood appearance and distribution of astaxanthin E/Z siomers among plasma lipoproteins in humans adminstered a single meal with astaxanthin. Abstract 2A-13. Abstracts of the Twelfth International Carotenoid Symposium, Cairns, Australia, 18-23 July 1999.
48. Guerin M, Huntley ME, Olaizola M, Haematococcus astaxanthin: applications for human health and nutrition, Trends Biotechnol, 21 (5), 210-216, 2003.
49. Jyonouchi H, Sun S, Mizokami M, Gross MD, Effects of various carotenoids on cloned, effector-stage T-helper cell activity, Nutr Cancer, 26 (3), 313-324, 1996.
50. Naito Y et al, Prevention of diabetic nephropathy by treatment with astaxanthin in diabetic db/db mice, BioFactors, 20 (1), 49-59, 2004.
51. Bennedsen M et al, Treatment of H. pylori infected mice with antioxidant astaxanthin reduces gastric inflammation, bacterial load and modulates cytokine release by splenocytes, Immunol Lett, 70 (3), 185-189, 1999.
52. Pedersen TH et al, Intracellular acidosis enhances the excitability of working muscle, Science, 305 (5687), 1144-7, 2004.
53. Greenhaff PL, Timmonns JA, Interaction between aerobic and anaerobic metabolism during intense muscle contraction, Exerc Sports Sci Rev, 26, 1-30, 1998.
54. Goldfarb AH, Antioxidants: role of supplementation to prevent exercise-induced oxidative stress, Med Sc Sports Exerc, 25 (2), 232-6, 1993.
55. Ikeuchi M, Koyama T, Takahashi J, Yazawa K, Effects of astaxanthin supplementation on exercise-induced fatigue in mice, Biol Pharm Bull, 29 (10), 2106-10, 2006.
56. Aoi W et al, Astaxanthin improves muscle lipid metabolism in exercise via inhibitory effect of oxidative CPT I modification, Biochem Biophys Res Commun, 366 (4), 892-7, 2008.
57. Azevedo JL et al, Training decreases muscle glycogen turnover during exercise, Eur J Appl Physiol, 78 (6), 479-486, 1998.








