
Dr. Giuseppe Musolino
Reparto di Dietetica e Nutrizione Clinica, Ospedale Civile di Vittorio Veneto (TV)
musolino.press@email.it
www.musolino.jimdo.com
Pubblicato su Coaching & Sport Science Journal, 2008
Riassunto
Il lavoro intende far luce su una questione da sempre irrisolta: a quale ratio è da ascrivere la causa della crescita muscolare? Per anni è stata mantenuta aperta la diatriba unicamente tra ipertrofia ed iperplasia. La realtà potrebbe essere diversa e prevedere un “terzo incomodo”: le cellule satelliti.
Nello sviluppo dell’articolo, è naturalmente posta in primo piano l’importanza di questi elementi per l’atleta, in considerazione del loro possibile intervento in seguito a danno muscolare indotto dall’allenamento, analizzando anche il ruolo stimolante su tali cellule da parte di vari fattori trofici.
Abstract
The article clarify one unsolved question: which ratio is from ascribing the cause of muscular increase? For many years it has been maintained opened the debate only between hypertrophy and hyperplasia. The truth could be different and predict a “third uncomfortable one”: the satellite cells.
Obviously, it is evidenced the importance of these elements for the athlete, in consideration of their possible participation as a result of muscular injury induced from training, also analyzing the stimulating role on such cells from several growth factors.
Parole chiavi
Cellule satelliti; danno muscolare; rigenerazione muscolare; fattori di crescita.
Keywords
Satellite cells; muscle injury; muscle regeneration; growth factors.
Introduzione
Ipertrofia o iperplasia? Per anni ci si è interrogati sulle possibilità di crescita muscolare. I più tradizionalisti non hanno mai voluto sentito parlare di iperplasia, imputando la ragione della crescita unicamente all’ipertrofia. I più “rivoluzionari”, intuendo che dovesse esserci qualcosa in più oltre alla crescita in volume della cellula, tirarono in ballo l’iperplasia. E per anni si è andati avanti per ipotesi: la cellula cresce; no, si divide; assolutamente no, si divide e poi cresce!
Molte cose non si spiegavano. Si parlava di sola ipertrofia, ma allora perché una parte di muscolo continua a permanere anche a sospensione dell’allenamento? Se fosse sola crescita in dimensioni, questa, col tempo, dovrebbe involvere, riportando la cellula ai suoi volumi originari. Per di più, biopsie effettuate su culturisti e sollevatori di peso hanno evidenziato fibre più piccole e scarsamente ipertrofiche nei bodybuilders (1), ma in numero maggiore (2). Particolare importante: il numero di mitocondri nei bodybuilders in questi studi risultò significativamente minore rispetto ai valori pre-esame.
Allo stesso modo, altre biopsie su nuotatori hanno rilevato cellule piccole ma numerose (3).
Ancora, altri studi già negli anni 80 evidenziarono che a seguito di sospensione di ogni attività, il muscolo dei ratti andava incontro ad ipotrofia, ma il numero di cellule rimaneva invariato (4). E infatti, dopo sospensione degli allenamenti, a ripresa degli stessi, il muscolo ritorna e anche abbastanza velocemente vicino ai volumi pre-sospensione. Si parlò allora di iperplasia, tanto più che negli animali tale fenomeno è dimostrato da tempo (5, 6, 7, 8). Nell’uomo, però, la probabilità dell’iperplasia è stata sempre osteggiata. E in effetti le cose stanno diversamente.
Cellule satelliti: una riserva nascosta
Nel corso dello sviluppo muscolare embrionale, i mioblasti, cellule embrionali di origine mesodermica, si fondono a formare le future miofibre. Durante la tarda fase della miogenesi, una distinta subpopolazione di mioblasti non si differenzia, ma rimane strettamente associata con la superficie delle miofibre sviluppate, in uno stato quiescente (9). Questi elementi, descritti per la prima volta da Mauro nel 1961 (10), sono le cellule satelliti (fig. 1).
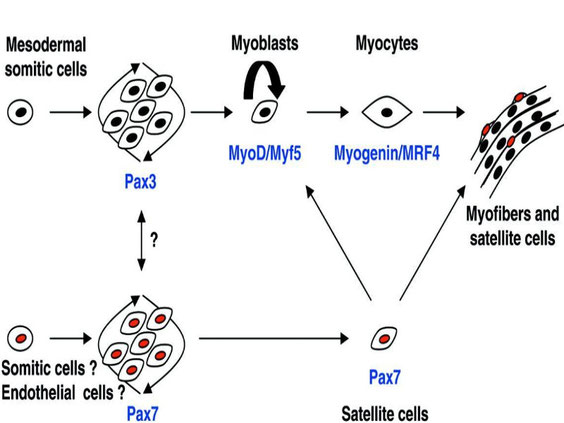
Fig. 1 Durante la miogenesi embrionale, i mioblasti, sotto l’influenza di vari fattori trascrizionali e di regolazione miogenica , si fondono, formando le miofibre. Una parte di essi, però, non va incontro a differenziazione e rimane intimamente aderente alla superficie delle miofibre sviluppate, in uno stato quiescente. Tali mioblasti indifferenziati sono noti col nome di cellule satelliti (9).
Esattamente, queste cellule risiedono al margine della lamina basale e la membrana plasmatica. Hanno un ridotto contenuto in organuli (ricordate i pochi mitocondri dei body builders?) e un nucleo piccolo, con molta cromatina (fig. 2), e ciò riflette l’evidenza che esse sono mitoticamente quiescenti e trascrizionalmente meno attive dei mioblasti (11, 12).
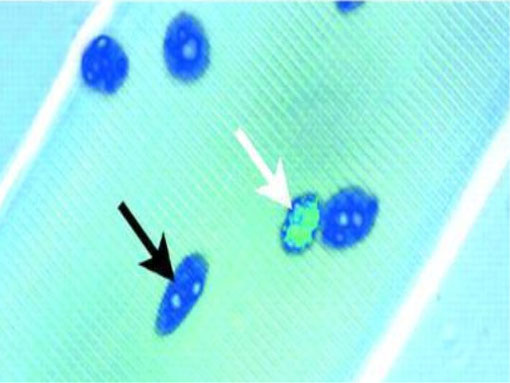
Fig. 2
I nuclei delle cellule satelliti (freccia bianca) si distinguono dai mioblasti (freccia nera) per il loro abbondante contenuto di eterocromatina, che riflette la loro quiescenza mitotica (9).
Le cellule satelliti sono presenti in tutti i muscoli e associate con tutti i tipi di fibre, sebbene con ineguale distribuzione. Per esempio, la loro percentuale nel soleo, tipico muscolo a fibre lente, è 2-3 volte superiore che nel tibiale, ricco di fibre veloci (13, 14, 15, 16).
Un’aumentata densità di cellule satelliti è stata osservata nell’inserzione del motoneurone (17) e adiacente ai capillari (18), il che suggerisce che alcuni fattori secreti da queste strutture possano giocare un ruolo nella sede delle cellule satelliti.
Rigeneratori muscolari
Le cellule satelliti presentano le caratteristiche di cellule staminali del muscolo adulto, essendo dotate di considerevole mobilità e della capacità di determinare mitosi. Dopo danno muscolare, infatti, hanno la capacità di intraprendere lo stesso percorso dei mioblasti embrionali, così si dividono e rigenerano il muscolo. In tal caso iniziano a proliferare, dando origine a mioblasti, i quali, dopo varie divisioni, in parte differenziano e si allineano, fondendosi tra loro e con le miofibrille esistenti nella struttura della lamina basale, in parte ritornano allo stato quiesciente, riproducendo la popolazione di cellule satelliti.
L’esistenza dei due tipi di popolazione di cellule satelliti è stata dimostrata da esperimenti condotti su topi. Una rappresenta l’80%, si divide rapidamente ed è responsabile nel fornire mioblasti ai ratti in crescita. Le altre, chiamate “cellule di riserva”, si dividono molto più lentamente e sono destinate a rimpiazzare il pool di cellule satelliti (19).
Le cellule satelliti funzionano dunque come progenitori delle miofibre che possono essere aggiunte durante la normale (post-natale) crescita muscolare. Ecco ciò che deve aver tratto in inganno i sostenitori dell’iperplasia: non sono le cellule muscolari a dividersi, ma le satelliti. Né ipertrofia né iperplasia, dunque, ma miogenesi: vera e propria genesi di tessuto muscolare.
Meccanismo
La rigenerazione conseguente ad un insulto è caratterizzata da due fasi: degenerativa e rigenerativa (fig. 3).
L’evento iniziale della degenerazione è avviato dalla distruzione del sarcolemma, la sottile membrana di origine connettivale ricoprente ciascuna delle fibre muscolari (teniamo a mente anche questo particolare). Ciò porta ad un aumento della permeabilità delle miofibre. La distruzione dell’integrità delle miofibre è confermata da aumentati livelli serici di proteine muscolari come la creatin-chinasi (CK) (9) e di idrossiprolina, un aminoacido presente nel collagene, che si libera in seguito a danno al connettivo.
La fase iniziale della riparazione muscolare è invece caratterizzata da necrosi del tessuto danneggiato e attivazione di una risposta antinfiammatoria (20). Questa fase è rapidamente seguita da attivazione delle cellule miogeniche, che escono così dal loro stato di quiescenza e iniziano a proliferare, differenziandosi e fondendosi infine in nuove miofibre (21, 22, 23). Tale attivazione, come visto, somiglia alla miogenesi embrionale: la riparazione muscolare sembra infatti ricapitolare quello che succede durante il processo di sviluppo embrionale.
L’attivazione non è ristretta al sito danneggiato. Infatti, un danno all’estremità di una fibra muscolare attiverà le cellule satelliti lungo tutta la fibra, comandandone la proliferazione e la migrazione nel sito da rigenerare (24). Comunque, il reclutamento di cellule satelliti da muscoli adiacenti è raramente osservato e richiede danno al tessuto connettivo che separa i due muscoli (24, 25).
Dopo la proliferazione, una rappresentanza di cellule satelliti è ripristinata sotto la lamina basale per altri giri di rigenerazione (24). Questo “auto-rinnovo” è un processo necessario, senza il quale ripetute rigenerazioni muscolari porterebbero rapidamente a deplezione del pool di cellule satelliti (9).
Le cellule satelliti così attivate potranno fondersi con le fibre esistenti o dar luogo a delle nuove. A questo punto, le nuove fibre saranno fibre intermedie, embrionali e perciò totipotenti: verranno quindi influenzate dal tipo di stimolo allenante, anche se più spesso finiscono per somigliare alle miofibre originali.
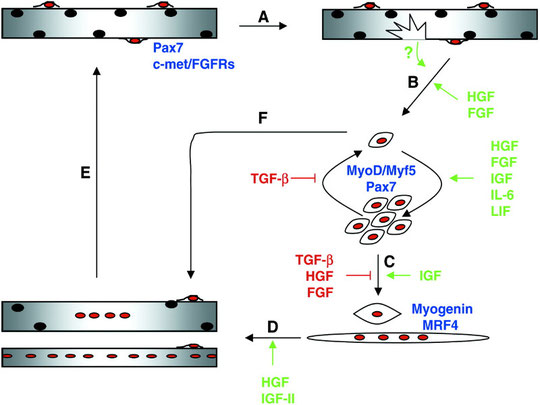
Fig. 3 A seguito del danno alle miofibre (A), le cellule satelliti quiescenti sono attivate per entrare nel ciclo cellulare e proliferare (B). La fase proliferativa è seguita dalla differenziazione terminale (C) e dalla fusione dei mioblasti nelle fibre danneggiate per ripararle o per formare di nuove (D). Finalmente, le miofibre nuove o riparate crescono per somigliare alle miofibre originali (E). Durante la rigenerazione, una sottopopolazione di mioblasti ritorna allo stato quiescente per rifornire il pool di cellule satelliti per successive riparazioni (F). Il processo è sotto il controllo di diversi fattori di crescita (9).
Fattori trofici
Studi in vitro hanno dimostrato il coinvolgimento di numerosi fattori trofici: HGF, Ossido Nitrico, IGF, TGF- β ecc.
HGF ha dimostrato di essere il primo fattore muscolare capace di indurre l’attivazione delle cellule satelliti quiescenti (26).
Il rilascio dell’Ossido Nitrico Sintasi (NOS) dalla lamina basale dopo stiramento o danno delle miofibre porta alla produzione di Ossido Nitrico (NO), il quale può attivare il rilascio di HGF (27, 28).
IGF-1 e 2, in vitro, sono capaci di promuovere sia la proliferazione che la differenziazione/fusione dei mioblasti (29, 30, 31, 32). Le diverse forme di IGF sono prodotti ubiquitari, ma le isoforme rilasciate dal muscolo si liberano in seguito a contrazione muscolare (soprattutto se intensa e prolungata) e in seguito alla lacerazione del connettivo, andando ad agire sul sito di rilascio: quindi sul muscolo stesso. Tali effetti sono attribuiti sia all’attivazione delle cellule satelliti a proliferare, fornendo più mionuclei, che a vera ipertrofia, attraverso aumentata sintesi proteica (33, 34, 35, 36).
Gli IGF inoltre attivano la miogenina, un gene essenziale nel passaggio da mioblasti a fibre mature: embrioni deficienti in miogenina, infatti, muoiono a causa di un deficit nella differenziazione del mioblasto, come evidenza di una totale assenza di miofibre (37, 38).
I TGF-β, invece, modulano in negativo l’attività dei mioblasti, inibendo sia la proliferazione che la differenziazione (39, 40).
Un ruolo chiave sulla capacità di riparare e rigenerare le fibre muscolari danneggiate lo ha poi il fattore di trascrizione MyoD. Tuttavia, senza il gene PC4, scoperto nel 2005 (41), la rigenerazione risulta gravemente compromessa. Tale gene rimuove l’inibizione di un regolatore negativo di MyoD, la Istone-Deacetilasi-4 (HDAC4). Fa, cioè, in modo fisiologico, quello che si ottiene con i farmaci inibitori delle deacetilasi: stimola le cellule satelliti a generare nuovo muscolo.
Fattori esogeni
La supplementazione di creatina, in associazione con un aumentato carico funzionale, porta ad un aumento dell’attività mitotica delle cellule satelliti (42).
Allo stesso modo, pur sottolineandone l’illiceità, l’immoralità e l’estrema pericolosità, ritengo professionalmente doveroso riportare quanto emerso da un recente studio circa gli steroidi anabolizzanti, i quali hanno dimostrato di spingere la crescita muscolare oltre i limiti genetici non solo incrementando la trascrizione di DNA per le proteine miofibrillari, ma anche aumentando la proporzione nucleo-citoplasma grazie all’aumento della velocità di attivazione delle cellule satelliti (43).
“Strappare” il muscolo
Ricordate il particolare della distruzione del sarcolemma? Bene, si dovranno riprodurre tramite l’allenamento quelle condizioni, necessarie all’attivazione delle cellule satelliti. Occorrerà cioè ricercare la lacerazione della membrana connettivale del muscolo. Attenzione, non sto parlando di macrolacerazioni nel muscolo, ma di microlesioni non evidenziabili neanche con la microscopia ottica.
Gli esercizi eccentrici sono potenti induttori di un simile danno muscolare (44, 45, 46). Questo spiegherebbe i differenti risutati bioptici evidenziati a inizio articolo tra body builders e sollevatori: questi ultimi infatti raramente eseguono frazioni eccentriche nei loro gesti, ricorrendo più spesso a movimenti parziali.
E lo “strappo” andrà ricercato principalmente nelle fibre bianche (ricordate l’ineguale distribuzione delle cellule satelliti nelle fibre muscolari?).
Quindi:
-
grossi carichi,
-
ripetizioni medio-basse (6-8),
-
accentuazione della fase negativa (eccentrica) del movimento
-
adeguato recupero tra una sessione e l’altra, come vedremo nel prossimo paragrafo.
Limiti e recupero
Nonostante le loro grandi potenzialità, le cellule satelliti presentano però l’handicap di essere generalmente molto limitate in numero. Per di più, la loro quantità tende a decrescere con l’età. E questo, insieme a svariati altri fattori, come ad esempio la miostatina (47), che contribuisce a mantenere le cellule satelliti in uno stato di quiescenza (48), può certamente contribuire a determinare il limite di crescita muscolare.
Anche in virtù di tali evidenze, in seguito a stimoli allenanti a loro carico, occorrerà concedere al muscolo un ottimale tempo di recupero tra una sessione e l’altra per permettergli un’adeguata supercompensazione. Ciò è confermato da esperimenti prevedenti iniezioni di cardiotossina, una sostanza causante una microlesione muscolare, in seguito alla quale il ritorno al muscolo morfologicamente ed istologicamente normale e maturo si ha in 3-4 settimane dopo la somministrazione (9).
Studi effettuati utilizzando esercizi pliometrici, anch’essi induttori di danno muscolare, hanno dimostrato una totale rigenerazione del tessuto muscolare danneggiato da contrazioni eccentriche dopo almeno sei giorni di riposo.
Conclusioni
Le cellule satelliti sono un argomento di grande attualità in campo medico per le loro promettenti possibilità di utilizzo in svariate patologie. L’interesse dell’atleta è invece rivolto alle loro potenzialità di attivazione e quindi di crescita muscolare in seguito ad opportuno stimolo allenante, un’evidenza destinata a rivoluzionare la tradizionale concezione della metodologia di allenamento.
BIBLIOGRAFIA
1. Tesch PA, Larsson L, Muscle hypertrophy in bodybuilders, Eur J Appl Physiol Occup Physiol, 49 (3), 301-6, 1982.
2. MacDougall JD, Sale DG, Elder GC, Sutton JR, Muscle ultrastructural characteristics of elite powerlifters and bodybuilders, Eur J Appl Physiol Occup Physiol, 48 (1), 117-126, 1982.
3. Hatfield F., Body building: a scientific approach, Contemporary books, Chicago, IL, 50, 1984.
4. Musacchia XJ, Steffen JM, Fell RD, Dombrowski MJ, Comparative morphometry of fibers and capillaries in soleus following weightlessness (SL-3) and suspension, Physiologist, 31(1 Suppl), S28-29, 1988.
5. Antonio J, Gonyea WJ, Skeletal muscle hyperplasia, Med Sci Sports Exerc, 25, 1233, 1993.
6. Antonio J, Gonyea WJ, Muscle fiber splitting in stretch-enlarged avian muscle, Med Sci Sports Exerc, 26 (8), 973-977, 1994.
7. Gonyea W, Ericson GC, Bonde-Petersen F, Skeletal muscle fiber splitting induced by weight-lifting exercise in cats, Acta Physiol Scand, 99 (1), 105-9, 1977.
8. Ho KW et al, Skeletal muscle fiber splitting with weight-lifting exercise in rats, Am. J. Anat., 157, 433, 1980.
9. Chargé SBP, Rudnicki MA, Cellular and Molecular Regulation of Muscle Regeneration, Physiol Rev, 84, 209-238, 2004.
10. Mauro A., Satellite cells of skeletal muscle fibres, J Biophys Biochem Cytol, 9, 493–495, 1961.
11. Schultz E, Gibson MC, Champion T, Satellite cells are mitotically quiescent in mature mouse muscle: an EM and radio-autographic study, Exp Zool, 206, 451-456, 1978.
12. Snow MH, A quantitative ultrastructure analysis of satellite cells in denervated fast and slow muscles of the mouse, Anat Rec, 207, 593-604, 1983.
13. Gibson MC, Schultz E, The distribution of satellite cells and their relationship to specific fiber types in soleus and extensor digitorum longus muscles, Anat Rec, 202, 329-337, 1982.
14. Rosenblatt JD, Lunt AI, Parry DJ, Partridge TA, Culturing satellite cells from living single muscle fiber explants in Vitro, Cell Dev Biol, 31, 773-779, 1995.
15. Schmalbruch H, Hellhammer U, The number of nuclei in adult rat muscles with special reference to satellite cells, Anat Rec, 189, 169-175, 1977.
16. Snow MH, A quantitative ultrastructure analysis of satellite cells in denervated fast and slow muscles of the mouse, Anat Rec, 207, 593-604, 1983.
17. Wokke JH, Van Den Oord CJ, Leppink GJ, Jennekens FG, Perisynaptic satellite cells in human external intercostal muscle: a quantitative and qualitative study, Anat Rec, 223, 174-180, 1989.
18. Schmalbruch H, Hellhammer U, The number of nuclei in adult rat muscles with special reference to satellite cells, Anat Rec, 189, 169-175, 1977.
19. Schultz E, Satellite cell proliferative compartments in growing skeletal muscles, Dev Biol, 175, 84-94, 1996.
20. Merly F, Lescaudron L, Rouaud T, Crossin F, Gardahaut MF, Macrophages enhance muscle satellite cell proliferation and delay their differentiation, Muscle Nerve, 22, 724-732, 1999.
21. Darr KC, Schultz E., Exercise-induced satellite cell activation in growing and mature skeletal muscle, J Appl Physiol, 63, 1816-1821, 1987.
22. Snow M.H., Myogenic cell formation in regenerating rat skeletal muscle injured by mincing. II. An autoradiographic study, Anat Rec, 188, 201-217, 1977.
23. Snow MH, An autoradiographic study of satellite cell differentiation into regenerating myotubes following transplantation of muscles in young rats, Cell Tissue Res, 186, 535-540, 1978.
24. Schultz E, Jaryszak DL, Valliere CR, Response of satellite cells to focal skeletal muscle injury, Muscle Nerve, 8, 217-222, 1985.
25. Schultz E, Jaryszak DL, Gibson MC, Albright DJ, Absence of exogenous satellite cell contribution to regeneration of frozen skeletal muscle, J Muscle Res Cell Motil, 7, 361-367, 1986.
26. Tatsumi R et al, HGF/SF is present in normal adult skeletal muscle and is capable of activating satellite cells. Dev Biol, 194, 114-128, 1998.
27. Anderson JE, A role for nitric oxide in muscle repair: nitric oxide-mediated activation of muscle satellite cells, Mol Biol Cell, 11, 1859-1874, 2000.
28. Tatsumi R, Hattori A, Ikeuchi Y, Anderson JE, Allen RE, Release of hepatocyte growth factor from mechanically stretched skeletal muscle satellite cells and role of pH and nitric oxide, Mol Biol Cell, 13, 2909-2918, 2002.
29. Coleman ME et al, Myogenic vector expression of insulin-like growth factor I stimulates muscle cell differentiation and myofiber hypertrophy in transgenic mice, J Biol Chem, 270, 12109-12116, 1995.
30. Doumit ME, Cook DR, Merkel RA, Fibroblast growth factor, epidermal growth factor, insulin-like growth factors, and platelet-derived growth factor-BB stimulate proliferation of clonally derived porcine myogenic satellite cells, J Cell Physiol, 157, 326-332, 1993.
31. Engert JC, Berglund EB, Rosenthal N, Proliferation precedes differentiation in IGF-I-stimulated myogenesis, J Cell Biol, 135, 431-440, 1996.
32. McFarland DC, Pesall JE, Gilkerson KK, The influence of growth factors on turkey embryonic myoblasts and satellite cells in vitro, Gen Comp Endocrinol, 89, 415-424, 1993.
33. Bark TH, McNurlan MA, Lang CH, Garlick PJ, Increased protein synthesis after acute IGF-I or insulin infusion is localized to muscle in mice, Am J Physiol Endocrinol Metab, 275, E118-E123, 1998.
34. Barton-Davis ER, Shoturma DI, Sweeney HL, Contribution of satellite cells to IGF-I induced hypertrophy of skeletal muscle, Acta Physiol Scand, 167, 301-305, 1999.
35. Musaro A, McCullagh KJ, Naya F.J., Olson E.N., Rosenthal N., IGF-1 induces skeletal myocyte hypertrophy through calcineurin in association with GATA-2 and NF-ATc1, Nature, 400, 581-585, 1999.
36. Semsarian C et al, Skeletal muscle hypertrophy is mediated by a Ca2+-dependent calcineurin signalling pathway, Nature, 400, 576-581, 1999.
37.Hasty P et al, Muscle deficiency and neonatal death in mice with a targeted mutation in the myogenin gene, Nature, 364, 501-506, 1993.
38. Nabeshima Y et al, Myogenin gene disruption results in perinatal lethality because of severe muscle defect, Nature, 364, 532-535, 1993.
39. Greene EA, Allen RE, Growth factor regulation of bovine satellite cell growth in vitro, J Anim Sci, 69, 146-152, 1991.
40. Lefaucheur J, Sebille A, Muscle regeneration following injury can be modified in vivo by immune neutralization of basic fibroblast growth factor, transforming growth factor beta 1 or insulin-like growth factor I, J Neuroimmunol, 57, 85-91, 1995.
41. Micheli L et al, PC4 Coactivates MyoD by relieving the Histone Deacetylase 4-Mediated inhibition of myocyte enhancer factor 2C, Molecular and Cellular Biology, 25 (6), 2242-2259, 2005.
42. Dangott B, Schultz E, Mozdziak PE, Dietary creatine monohydrate supplementation increases satellite cell mitotic activity during compensatory hypertrophy, Int J Sports Med, 21 (1), 13-16, 2000.
43. Aagaard P, Making muscles “stronger”: exercise, nutrition, drugs, J Musculoskelet Neuronal Interact, 4 (2), 165-174, 2004.
44. Irintchev A, Wernig A, Muscle damage and repair in voluntarily running mice: strain and muscle differences, Cell Tissue Res, 249, 509-521, 1987.
45. Faulkner JA, Brooks SV, Opiteck JA, Injury to skeletal muscle fibers during contractions: conditions of occurrence and prevention, Phys Ther, 73, 911-921, 1993.
46. Armstrong RB, Warren G.L., Warren J.A., Mechanisms of exercise-induced muscle fibre injury, Sports Med, 12, 184-207, 1991.
47. Musolino G, “Miostatina: ruolo inibitorio sullo sviluppo muscolare”, Chinesiologia, 23 (3), 23-26, 2005.
48. McCroskery S et al., Myostatin negatively regulates satellite cell activation and self-renewal, The Journal of Cell Biology, 162 (6), 1135-1147, 2003.








